Allopathie Fertigarzneimitteln
Die Medizin wendet pharmakologisch, immunologisch
oder metabolisch wirkende Stoffe als Arzneimittel an.
Diese wurden in den vergangenen Jahrhunderten fast ausschließlich vom Apotheker
auf ärztliches Rezept individuell angefertigt. Seit Beginn des 20. Jahrhunderts
wurden immer mehr Arzneimittel industriell hergestellt. Dies veranlasste den
Bundesgesetzgeber erstmals 1961 dazu, den Arzneimittelverkehr bundeseinheitlich
zu regeln. Mit dem Contergan-Skandal traten die Schwächen des Arzneimittelgesetzes
(AMG), welches kein Zulassungsverfahren für Fertigarzneimittel vorsah, deutlich
zutage. Der Gesetzgeber reagierte – nicht zuletzt auch in Erfüllung
europarechtlicher Vorgaben – und novellierte das Arzneimittelrecht zum 1.1.1978
grundlegend, indem er die Verkehrsfähigkeit eines Fertigarzneimittels davon
abhängig macht, dass zuvor eine Zulassung erteilt wurde, die der
pharmazeutische Unternehmer zu beantragen hat. Mit dem Antrag hat er die
Qualität, Wirksamkeit und Unbedenklichkeit seines Arzneimittels darzulegen.
Ist ein Arzneimittel zugelassen, gilt es als
unbedenklich, solange nicht Erkenntnisse, die nach der Zulassung gewonnen
wurden, andere Interpretationen erzwingen. Kommt es gleichwohl zu einem Schaden
infolge bestimmungsgemäßer Anwendung des Arzneimittels, greift die
arzneimittelrechtliche Gefährdungshaftung gemäß § 84 AMG, sofern die
schädigende Wirkung über ein nach den Erkenntnissen der medizinischen
Wissenschaft vertretbares Maß hinausgeht oder der Schaden infolge einer nicht
den Erkenntnissen der medizinischen Wissenschaft entsprechenden Kennzeichnung,
Fachinformation oder Gebrauchsanweisung eingetreten ist. Wenn das jeweilige
Arzneimittel prinzipiell geeignet ist, einen Schaden zu verursachen, wird
vermutet, dass es diesen Schaden auch verursacht hat.
… und bei
Rezepturarzneimitteln
Anders ist die Rechtslage, wenn Arzneimittel als
Rezepturarzneimittel abgegeben werden: Pharmazeutischer Unternehmer ist dann
der Apotheker, welcher zwar für Fehler des Arzneimittels nach dem
Produkthaftungsgesetz sowie nach den allgemeinen Vorschriften der
Verschuldenshaftung haftet, aber keinen Wirksamkeitsnachweis erbringen muss. Er
stellt das Arzneimittel aufgrund einer Verordnung des Arztes (oder
Heilpraktikers) her und ist hierzu sogar in der Regel verpflichtet, solange es
sich nicht um ein bedenkliches Arzneimittel i.S.d. §
5 AMG handelt [4].
Der Arzt übernimmt mit seiner Entscheidung für
eine bestimmte Arzneimitteltherapie die alleinige (haftungsrechtliche)
Verantwortung dafür, dass seine Therapie vertretbar ist. Zu berücksichtigen ist
dabei, dass seit Inkrafttreten der 15. AMG-Novelle im Juli 2009 auch der Arzt
den Vorschriften des AMG unterliegt und sich u. a. strafbar macht, wenn er
bedenkliche Arzneimittel anwendet.
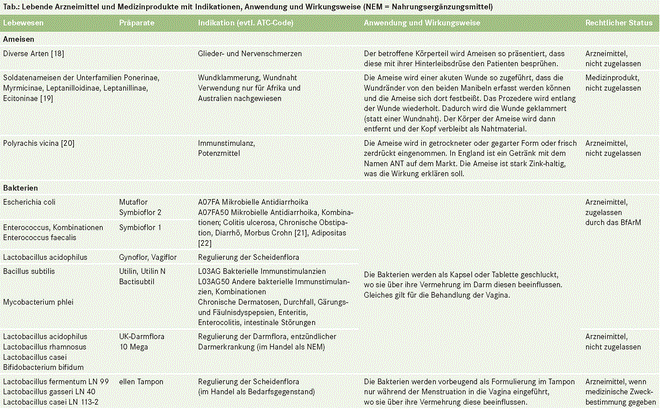
Aus folgenden Gründen bergen lebende Arzneimittel
besondere Risiken für den Patienten:
Sie sind per definitionem nicht steril (wären sie
steril, wären sie nicht mehr lebend).
Sie sind (weil Lebewesen) unberechenbar, weshalb
es besonders schwer nachzuweisen ist, dass sie den gestellten
Qualitätsansprüchen genügen.
Dies gilt umso mehr, wenn sie nicht
"isoliert" zum Einsatz kommen können, weil sie in Symbiose mit
anderen Organismen leben.
So sind beim Blutegel regelmäßig Bakterien im
Magen anzutreffen (Aeromonas hydrophila), die in die Blutbahn des Patienten gelangen
können [5]. Da Blutegel auch vor der Anwendung Blut zu sich genommen haben, ist
ihre Abgabe im Sinne des Transfusionsgesetzes laut Apothekenbetriebsordnung zu
dokumentieren und 30 Jahre lang zu archivieren [6]. Auch Fliegenmaden aus der
Schweiz, die dort desinfiziert und mit dem Vorbehalt der Unsterilität von einem
Tierfutterhändler (ohne behördliche Genehmigung) zur Wundbehandlung angeboten
werden [7], werden kaum die arzneimittelrechtlich zu fordernde Qualität
vorweisen können.
Allgemein gilt, dass der Einsatz von nicht
zugelassenen Fertigarzneimitteln verboten ist [8]. Dabei sind alle
Arzneimittel, die von einer Apotheke "im Voraus", also nicht aufgrund
eines einzelnen Rezeptes, sondern in Serie für ein Patientenkollektiv
hergestellt werden, als Fertigarzneimittel anzusehen [9]. Der Charakter als
Einzelrezeptur kann verloren gehen, wenn ein Arzneimittel systematisch beworben
wird [10]. Die Voraussetzungen für eine zulassungsfreie defekturmäßige
Herstellung von Fertigarzneimitteln sind durch § 21 Abs. 2 Nr. 1 AMG ebenfalls
sehr eng gezogen [11].
Qualität lebender
Arzneimittel
Die Qualität von Arzneimitteln unterliegt den
höchsten rechtlichen und qualitativen Anforderungen, die niedergelegt sind in
der Arzneimittel- und Wirkstoffherstellungsverordnung (AMWHV) und im
EG-GMP-Leitfaden [12].
Die AMWHV findet "Anwendung auf Betriebe und Einrichtungen, die Arzneimittel oder Wirkstoffe, die zur Herstellung von Arzneimitteln bestimmt sind und die menschlicher oder tierischer oder mikrobieller Herkunft sind", also auch auf alle lebenden Arzneimittel. Sie stellt Anforderungen an ein vorhandenes Qualitätsmanagementsystem (§ 3 AMWHV), an das handelnde Personal (§ 4 AMWHV), an die Betriebsräume und an die verwendete Ausrüstung (§ 5 AMWHV), an die Hygiene (§ 6 AMWHV), an die Lagerung und den Transport (§ 7 AMWHV), an die Tierhaltung (§ 8 AMWHV) sowie weitere der pharmazeutischen Herstellung zugrunde liegende Gegebenheiten. Die Herstellung selbst muss in qualifizierter Umgebung nach validierten Verfahren (§ 13 AMWHV) durchgeführt werden. All diese Schritte sind
bei lebenden Arzneimitteln mit besonderen
Schwierigkeiten verbunden.
Beispiele
Schweinepeitschenwürmer werden aus dem Kot von
Schweinen isoliert und dann zur Eiablage veranlasst. Die Eier werden sodann vom
Patienten oral eingenommen. Hygienemaßnahmen und die Validierung
des Verfahrens bereiten hier besondere Schwierigkeiten. Die Qualität wäre auch
an der Schlupfrate der Eier zu messen – eine sehr schwer überprüfbare
Messgröße.
Blutegel werden in der Türkei gesammelt und nach
einer Wartephase in Deutschland angewendet. Die Forderungen einer Guten
Herstellungspraxis sind hier nicht einfach realisierbar. Gleiches gilt für alle
in der Natur gesammelten Organismen wie zum Beispiel Schafsläusen, die an
Schafen gesammelt werden.
Auch für die Herstellung solcher Arzneimittel gilt
der Annex 1 "Herstellung steriler Arzneimittel" des
EG-GMP-Leitfadens, weil sie entweder oral (fast alle Mikroorganismen wie z.B. Escherichia coli,
ganze Tiere wie z.B. Trichuris suis oder Melophagus
ovinus) oder parenteral
(Apis mellifera, Anopheles spp.,
Hirudo officinalis)
oder durch Kontakt zu verletzter Haut (Lucilia
sericata, Phagen)
eingesetzt werden oder auf andere Weise in den menschlichen Körper eindringen,
wie Necator americanus.
Parenteralia und
Präparate mit Kontakt zu verletzter Haut müssen steril sein, andere müssen ihre
Qualität und Unbedenklichkeit auch mikrobiologisch belegen.
Nach §14 AMWHV sind die Arzneimittel schließlich
in allen Schritten der Herstellung unter der Verantwortung des Leiters der
Qualitätskontrolle zu prüfen, sodann zu kennzeichnen und nach § 16 AMWHV durch
eine sachkundige Person (QP) für die Inverkehrbringung
freizugeben.
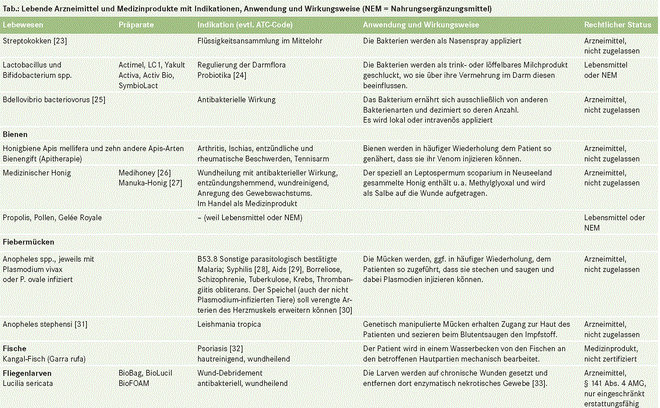
Fliegenlarven, Plasmodien-übertragende
Fiebermücken, Eier vom Schweinepeitschenwurm oder Phagen
gehören nicht zum Standardsortiment deutscher Apotheken und können auch vom
kundigen Mediziner in der benötigten Qualität nicht ohne erheblichen Aufwand
selbst beschafft werden. Einige dieser Organismen werden von Spezialfirmen
hergestellt und vertrieben. Andere sind nur auf dem "schwarzen (Internet-)
Markt" erhältlich.
Ob der Apotheker die Produkte spezialisierter
Hersteller abgeben darf, hängt von deren Verkehrsfähigkeit ab. In der Regel
handelt es sich bei diesen Produkten um Fertigarzneimittel (§ 4 Abs. 1 AMG),
die gemäß § 21 AMG der Zulassungspflicht unterliegen. Tatsächlich besitzt
jedoch kein lebendes Arzneimittel (außer Mikroorganismen) in Deutschland eine
Zulassung.
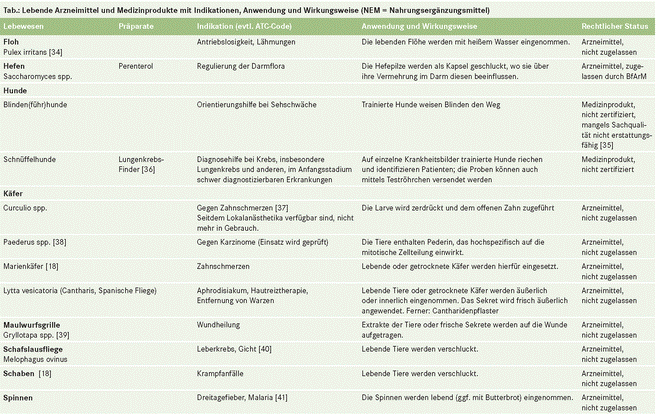
Es stellt sich die Frage, warum Therapien mit
lebenden Arzneimitteln in Deutschland an Popularität gewinnen. Der Grund ist in
vielen Fällen der gleiche: Die Patienten leiden unter einer Krankheit, auf
welche die Schulmedizin keine Antwort hat, und sie gehen davon aus, dass eine
"biologische" Therapie per se ungefährlich ist. So wurden genetisch
manipulierte Anopheles zur "Impfung" gegen Leishmaniose
vorgeschlagen, oder es werden Borreliose- oder
HIV-Patienten mit Malaria infiziert, obwohl die ursprünglich zur Behandlung der
(damals unheilbaren) Syphilis eingesetzte "Malariatherapie" (für die
Julius Wagner-Jauregg 1927 den Nobelpreis für Medizin
erhalten hatte) heute als obsolet gilt.
Auch die Verwendung von Schweinepeitschenwürmern
findet zunehmend Anhänger. Medien berichten, dass für das Wohlbefinden eine
Wurminfektion von Vorteil sei [13], und wecken bei schwerkranken Patienten
irrationale Hoffnungen. Der "Fall" Regividerm,
einer als Medizinprodukt vertriebenen Salbe gegen Neurodermitis, zeigt das
Problem deutlich auf [14].
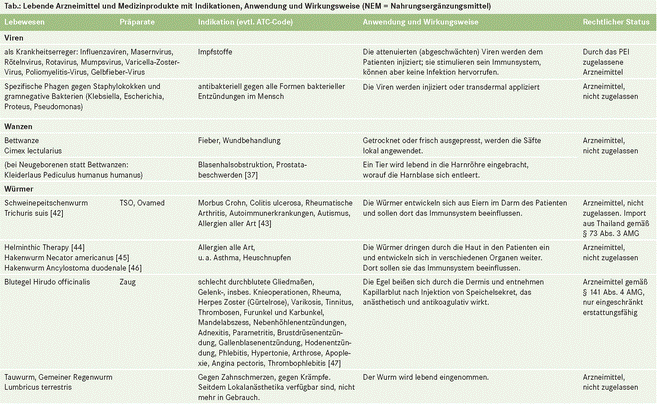
Angebot im Internet
Die meisten der in der Tabelle aufgelisteten
Arzneimittel sind in Deutschland nicht als Fertigarzneimittel erhältlich und
werden doch in teilweise erheblichem Umfang eingesetzt. Je größer der
Leidensdruck der Patienten ist, wie zum Beispiel bei Colitis
ulcerosa, Borreliose oder
Krebs, desto mehr wächst ihre Bereitschaft, solche Arzneimittel via Internet zu
bestellen und mit oder ohne ärztliche Unterstützung anzuwenden. Der nach dem
deutschen Arzneimittelrecht formulierte Qualitätsstandard ist dann nicht mehr
gewährleistet.
Zwar ist die Werbung für nicht zugelassene, aber
zulassungspflichtige Arzneimittel gemäß Heilmittelwerbegesetz (§ 3a HWG) und §
8 AMG verboten. Nicht untersagt ist dagegen die Werbung für
Rezepturarzneimittel. Zudem sind wissenschaftliche Berichte erlaubt, wobei die
Wissenschaftlichkeit aber nicht selten zu wünschen übrig lässt.
Wirksamkeitsnachweis
Einige lebende Arzneimittel werden seit langer
Zeit angewendet, sodass vielfältige Erfahrungen und Erfahrungsberichte
vorliegen. Moderne klinische Studien sind jedoch selten. Uns sind für alle
aufgelisteten höheren Organismen (also ohne die Mikroorganismen) folgende
Studien bekannt:
eine Studie zur biochirurgischen Anwendung von
Fliegenlarven [15], welche nur eine Teilwirkung (Debridement
durch Larven in der Wundbehandlung) belegen konnte, und
eine Studie zu Trichuris
suis [16], die hier nicht bewertet werden soll,
sowie
·
mehrere Studien über Blutegel [17].
Fazit
Aufgrund der hohen Qualitätsansprüche von
Arzneimitteln können lebende Arzneimittel grundsätzlich nicht ohne Weiteres in
Apotheken, sondern nur von darauf spezialisierten Firmen hergestellt werden.
Dies ist uneingeschränkt nur auf der Basis einer Zulassung als Fertigarzneimittel
erlaubt. Eine rezepturmäßige Herstellung in der
Apotheke wiederum kommt nur in Betracht, wenn der Apotheker selbst
substanzielle Herstellungsschritte für die Herstellung des Arzneimittels
unternimmt.
Solange weder die Wirkstoffe in Art, Menge und
Struktur noch ihre Wirkungsmechanismen bekannt sind und solange weder die sich
daraus ableitende Wirksamkeit noch die Unbedenklichkeit klinisch belegt ist,
sollten lebende Arzneimittel nur unter medizinischer Kontrolle und ärztlicher
Verantwortung als Therapieversuch mit Rezepturarzneimitteln zum Einsatz kommen.
Quellen
[1] Kloesel/Cyran: Kommentar zum AMG, § 3 (Stoffbegriff) Nr. 3
Blatt 151. [2] X. Boergen, C. Jäckel, J.-P. Spiegel:
Lebende Arzneimittel. Pharma Recht 2008;30:357 – 400. [3] Michael Schmidt:
Arzneimittel von Tieren. PTAheute 2010;24:30 – 33.
[4] § 17 Abs. 4 ApBetrO; Cyran/Rotta,
Kommentar zur Apothekenbetriebsordnung § 17 Rdnr.
485. [5]
M. Roth: Ein
Tier heilt Tiere – der medizinische Blutegel. ATM-Nachrichten
15:1 – 5; www.blutegel.de/egel/opencms/de/blutegel_de/animals.html
[6]
Apothekerkammer
Nordrhein: Alternative Therapieformen, Rechtliches zu Eigenblutnosoden
und Blutegeln in der Apotheke. Kammer im Gespräch 3/2009, S. 11. [7]
Entomos AG, www.entomos.ch [8] J.K. Schweim,
H.G. Schweim: Arzneimittel, Medizinprodukte und
Nahrungsergänzungsmittel – ein Vergleich. DAZ.online,
März 2010. [9]
LSG
Niedersachsen-Bremen, Urteil vom 15.2.2005, Az. L 4
KR 44/01. [10] OLG Köln, Urteil vom 21.3.2003, Az. 6
U 160/02. [11] Vgl. BVerwG, Urt. v. 9.3.1999, Az. 3 C 32/98;
BGH, Urt. vom
23.6.2005, Az. I ZR 194/02. [12] Dagmar Krüger: GMP
bei der Arzneimittel- und Wirkstoffherstellung. Wissenschaftliche
Verlagsgesellschaft Stuttgart 2009. [13]
Jörg Blech:
Fehlkonstruktion Mensch: Warum wir für die moderne Welt nicht geschaffen sind.
Der Spiegel 40/2009;
A. Sommer, M.
Schaefer: Quarks und Co., Fernsehsendung des WDR vom 13.10.2009, 21:00 – 21:45.
[14]
Klaus Martens,
Karten Klingelhöller: "Heilung unerwünscht. Wie
Pharmakonzerne ein Medikament verhindern", Fernsehsendung der ARD vom
21.10.2009;
Martin U.
Müller: Übler Nachgeschmack, Der Spiegel 44/2009;
Doris Uhl:
Dick aufgetragen: Der ARD-Film "Heilung unerwünscht". Dtsch. Apoth. Ztg.
2009;149:5014 – 5018. [15]
J.C. Dumville, et al. on
behalf of the VenUS II team: VenUS
II: a randomised controlled trial of larval therapy in the management of leg
ulcers. Health Technology Assessment 2009;13(55).
DOI: 10.3310/hta13550, www.hta.ac.uk/pdfexecs/summ1355.pdf
[16]
R.W. Summers, et al.: Trichuris
suis therapy for active ulcerative colitis: a
randomized controlled trial. Gastroenterology 2005;128(4):1117 – 9; author
reply: Gastroenterology
2005;129(2):768 – 9. [17] M. Aurich, D. Koeppen: Eine Anwenderumfrage zur
Blutegeltherapie – Auswertung von 171 Falldokumentationen. zkm
Zeitschrift für Komplementärmedizin 2009;5:12– 18. [18] www.20min.ch/diashow/diashow.tmpl?showid=29081.
[19]
www.newworldencyclopedia.org/entry/Army_ant.
[20]
www.food-insects.com/Vol7%20no2.htm;
http://news.bbc.co.uk/2/hi/health/1809450.stm.
[21]
P. Jungmayr: Mukosale
Barrierestörung. Dtsch. Apoth. Ztg. 2009;149:5450.
[22] (cae):
Essen –
Bazillen – Adipositas. Dtsch. Apoth.
Ztg. 2009;149:5515. [23]
(ral): Bakterien-Spray hilft gegen Flüssigkeit im Ohr.
Dtsch. Apoth. Ztg. 2010;150:1396. [24] www.online-academy.ch/content_details.php?sprache=d&aid=38;
www.zdf.de/ZDFmediathek/beitrag/video/739762/drehscheibe-am-22.-April-2009#/beitrag/video/739762/drehscheibe-am-22.-April-2009
[25]
www.zeit.de/2004/07/M-Saugkiller.
[26]
www.medihoney.de/sites/home_honig.html.
[27]
www.newzealandhoneyshop.de. [28] W. Sama, et al.: Distribution of survival times of deliberate
Plasmodium falciparum infections in tertiary syphilis
patients. Trans. Royal Soc. Trop. Med. Hyg.
2006;100(9); 811 – 6. [29]
D.M. Aronoff: Using live
pathogens to treat infectious diseases: a historical perspective on the
relationship between GB virus C and HIV. Antiviral Ther.
2002;7(2):73 – 80; www.circare.org/malariotherapy.htm. [30]
www.20min.ch/diashow/diashow.tmpl?showid=29081. [31]
S. Yoshida, H. Watanabe: Robust salivary
gland-specific transgene expression in Anopheles stephensi Mosquito. Insect Mol. Biol. 2006;15(4):403– 410; http://news.sciencemag.org/sciencenow/2010/03/researchers-turn-mosquitoes-into.html.
[32]
http://ecam.oxfordjournals.org/cgi/content/full/3/4/483.
[33] H. Heuer, L. Heuer: Seraticin – ein antibiotischer Wirkstoff von Fliegenlarven. Dtsch. Apoth. Ztg. 2010;150:394 f. [34]
Kristian Franz
Paullini: Heilsame Dreck-Apotheke. Frankfurt am Main
1696, Kapitel II, S. 16;
http://diglib.hab.de/drucke/xb-3174/start.htm
[35] Bundesanzeiger Nr. 117 vom 29.06.1993; T. Wabnitz:
Medizinprodukte als Hilfsmittel in der gesetzlichen Krankenkasse.
Springer-Verlag, Berlin, 2009; Urteil des BSG vom 25.02.1981, Az. 5a/5 RKn 35/78. [36]
Lungen-Krebs-Finder,
Darwin GmbH; www.lungen-krebs-finder.de
[37] Königlicher Gerichtsamtmann Keferstein: Über den unmittelbaren Nutzen der
Insekten. Maring’sche Buchhandlung, Erfurt 1827. [38]
www.forces.gc.ca/health-sante/wn-qn/adv-avi/Paederus-eng.asp
[39]
www.carstens-stiftung.de/nachwuchs/promotionsfoerderung/abstracts/nhk/zimmer.pdf
[40] Paullini (wie [34]), Kapitel XXX, S. 269f. [41] Paullini (wie [34]),Kapitel II, S. 284; www.ent.orst.edu/burgettm/ent300_lecture21.htm [42] P. Bager, et al.: Trichuris suis ova therapy for allergic rhinitis: a randomized,
double-blind, placebo-controlled clinical trial. J. Allergy Clin.
Immunol. 2010;125(1):123-30.e1-3. Epub
2009 Oct 3. [43]
www.ovamed.org [44]
www.nytimes.com/2008/07/01/health/research/01prof.html [45] A. Reddy, B.
Fried: An update on the use of helminths to treat Crohn‘s and other autoimmunune
diseases. Parasitol. Res. 2009;104(2):217-21. [46]
www.tagesanzeiger.ch/leben/heuschnupfen/Auf-den-Wurm-gekommen/story/13704365
[47]
Autoren
Apothekerin Heike Heuer und Dr. Lutz Heuer, Am
Krausberg 31, 41542 Dormagen
Dr. jur. Valentin Saalfrank, Berrenrather
Str. 393, 50937 Köln
Vorwort/Suchen Zeichen/Abkürzungen Impressum